Les impacts délétères du changement climatique sur la santé des populations sont indéniables. En parallèle, les activités du système de santé, tout en étant vitales, exercent une pression significative sur l'environnement. Elles contribuent au réchauffement climatique, représentant plus de 8 % des émissions de gaz à effet de serre de la France pour le secteur sanitaire et 1,3 % pour la branche autonomie. Elles engendrent aussi des nuisances spécifiques : stockage et utilisation de produits dangereux, productions de déchets à risque infectieux, rejets de liquides particuliers... La conscience grandissante de cette réalité a engendré une série d'initiatives des acteurs du système de santé, à l'échelle locale et nationale. La HAS entend également prendre toute sa part dans cette dynamique positive et essentielle pour l’avenir.
Après avoir complété son projet stratégique 2019-2024 d’un volet sur les enjeux environnementaux et mené une première série d’actions, la HAS souhaite donner un cadre stratégique et opérationnel à son engagement d’intégrer, structurellement et sur le long terme, les enjeux de santé-environnement dans l’ensemble de ses missions et travaux.
Intégrer les enjeux environnementaux au cœur des missions de la Haute Autorité de santé
Afin de contribuer à réduire l'empreinte écologique du système de santé tout en améliorant les soins et les accompagnements dispensés, la HAS structure son action conformément à ses trois missions fondamentales : évaluer les technologies de santé, recommander les bonnes pratiques professionnelles et mesurer la qualité des soins et des accompagnements pour l’améliorer.
- Consolider les critères environnementaux dans l’évaluation des technologies de santé et développer leur bon usage pour limiter leur impact environnemental. Le renforcement d’une perspective environnementale dans l'évaluation des technologies de santé est un moyen d’agir sur l’offre. La promotion du bon usage des technologies de santé poursuit quant à elle le triple objectif d’améliorer la qualité des soins, de réduire les dépenses de santé inutiles et de minimiser l’impact des technologies de santé sur l'environnement.
- Élaborer des recommandations de bonnes pratiques en encourageant une meilleure prise en compte des enjeux environnementaux. Dans un contexte où l'impact du système de santé sur le changement climatique est avéré, l'accent est mis sur la nécessité de renforcer la prévention et la pertinence des soins. Cette approche vise à maintenir la santé de la population, préserver le capital santé individuel, éviter les traitements inadéquats et réduire l'utilisation des soins en retardant l'apparition ou en limitant la gravité des maladies. La HAS a déjà consacré des efforts notables à la prévention primaire, elle aspire à développer davantage les travaux liés à la prévention secondaire et tertiaire pour améliorer la santé publique tout en réduisant l'impact écologique des soins.
- Renforcer les critères liés à la santé-environnement dans la mesure de la qualité des soins et des accompagnements. La HAS souhaite élargir les exigences des critères liés à la santé-environnement dans les référentiels de certification des établissements de santé et d’évaluation des établissements des services sociaux et médico-sociaux pour promouvoir des pratiques respectueuses de l'environnement et une adaptation au changement climatique. Elle envisage également d’intégrer dans les programmes d'accréditation des médecins et des équipes médicales, des actions pour limiter l'impact environnemental de leurs pratiques.
Se donner les moyens de ses ambitions
L'intégration de la santé-environnement au cœur des missions de la HAS exige une démarche transversale impliquant notamment une sensibilisation et une formation approfondies de ses agents. Afin de bénéficier des avancées et des connaissances pointues sur ce sujet, la HAS œuvrera à l'intégration d'experts en santé-environnement à chaque étape de ses travaux. L'objectif est de les inclure dans les instances internes selon les besoins identifiés, tout en formant en interne un réseau de référents spécialisés sur ces questions.
Consciente de la complexité des enjeux environnementaux, la HAS aspire à une approche collaborative et partenariale. Pour bénéficier d’une expertise variée, la HAS s'engage à établir des partenariats avec divers acteurs, que ce soit dans le secteur public, privé ou associatif, au niveau national ou international.
Ces actions ambitieuses représentent le premier chapitre d'une série d'initiatives que la HAS entreprend pour inscrire durablement la santé-environnement dans ses missions fondamentales... lire le Communiqué de Presse de la Haute Autorité de Santé (HAS) - Feuille de route santé-environnement de l'HAS [PDF] -



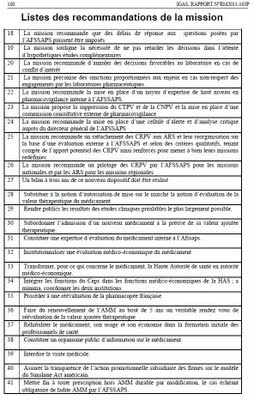
 Plan de la Synthèse du "Rapport sur la pharmacovigilance et gouvernance de la chaîne du médicament"
Plan de la Synthèse du "Rapport sur la pharmacovigilance et gouvernance de la chaîne du médicament"
 08/02/2011 - Le
08/02/2011 - Le  26 octobre 2010 - Déclarations des aides versées aux associations par les industriels de santé : la HAS publie les chiffres pour 2009 -
26 octobre 2010 - Déclarations des aides versées aux associations par les industriels de santé : la HAS publie les chiffres pour 2009 -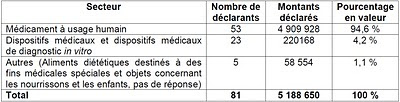
 La
La  1 décembre 2009 -
1 décembre 2009 -  15 février 2008 -
15 février 2008 - 