Au moment où l’emploi et la ré-industrialisation de la France sont des sujets majeurs du débat public, le G5 Santé tient à rappeler que, dans un contexte de crise économique sans précédent, les industries de santé sont un atout majeur du pays pour l’emploi, la compétitivité, l’indépendance sanitaire et l’innovation.
Sur la base d’un diagnostic approfondi et publié sous forme d’un Livre Blanc, le G5 santé énonce 10 propositions clés pour répondre aux défis auxquels la France est confrontée dans le secteur des industries de la Santé. L’objectif est double : répondre mieux aux besoins de santé des Français et renforcer la place de la France en matière de santé dans la compétition internationale.
Pour le G5, le seul moyen d’y parvenir est de mener rapidement une double action :
- Développer une filière santé dynamique dans un monde médical en mutation accélérée
- Refonder le dialogue avec les Pouvoirs publics au service de la santé des Français et de l’emploi
Reconnaître l’utilité économique et sociétale de la filière de santé :
1. Restaurer une vision stratégique commune et un dialogue fructueux entre les pouvoirs publics et les industries de santé, pour rénover la gouvernance politique et administrative
2. Respecter l’innovation, tenir compte des logiques industrielles dans la conduite des politiques de régulation et de fixation des prix, et mesurer l’impact des réformes sur les industries de santé, en étendant l’obligation d’études d’impact des décisions publiques aux conséquences sur la filière des industries de santé
3. Structurer une filière de santé pérenne pour réindustrialiser la France, en soutenant le Comité Stratégique de Filières (CSF), notamment en adoptant la notion de Service Sociétal et Environnemental rendu (SSER), en appuyant l’émergence de nouvelles filières à fort potentiel d’industrialisation, et en associant les acteurs pour répondre aux grands enjeux de santé publique
4. Favoriser l’emploi et la formation aux métiers des industries de santé par la création d’un guichet unique pour la mise en adéquation offre/demande de compétences, la réalisation d’une cartographie des besoins d’emploi et de formation, la mutualisation de plateformes en recherche publique, et en promouvant un plan national pour les formations et carrières mixtes
Rénover la gouvernance de l’accès au marché des innovations :
5. Refonder l’accès au marché et encourager l’innovation, notamment en instaurant des critères objectifs et durables de fixation des prix, en élargissant la notion d’Amélioration du Service Médical Rendu (ASMR), en évaluant le médicament tout au long de son cycle de vie, et en permettant un enregistrement plus rapide des innovations de rupture
6. Créer une instance interministérielle d’arbitrage, rattachée au plus haut niveau de l’état, chargée d’arbitrer les grands équilibres financiers, sanitaires, industriels, et de recherche, tout en pérennisant le Comité Stratégique des Industries de Santé (CSIS)
Développer une politique de recherche concertée :
7. Préserver le Crédit d’impôt recherche et développer les partenariats public/privé, notamment en faisant de l’Agence de Recherche et d’Innovation des Industries de Santé (ARIIS), de l’Agence Nationale de Recherche (ANR), et de l’Alliance pour les Sciences de la Vie et de la Santé (AVIESAN) de véritables pôles de pilotage des partenariats, tout en développant les pôles de compétitivité
8. Permettre aux industries de santé de maintenir une R&D de haut niveau, en développant des politiques fortes de soutien à la R&D publique et privée notamment par des programmes d’action nationaux (comme pour le cancer)
Promouvoir la place de la France à l’international :
9. Favoriser l’émergence de champions nationaux des dispositifs médicaux et des solutions multitechnologiques en améliorant le financement des nouveaux produits de rupture. La France devrait être pilote dans la définition des standards et des normes qui contribueront au lancement de nouveaux paradigmes
10. Soutenir le développement international des entreprises de santé au service d’une véritable diplomatie sanitaire, en créant un crédit export pour les PME de santé, en développant des partenariats stratégiques avec les universités internationales, et en déployant une véritable diplomatie sanitaire à destination des zones d’influence française
Le G5 santé, porte-voix des industries de santé françaises, est un cercle de réflexion qui rassemble les dirigeants des principales entreprises françaises de santé et des sciences du vivant (bioMérieux, Ipsen, le LFB, Pierre Fabre, Sanofi). Celles-ci ont choisi la France comme plateforme de leur développement international et font de l’effort de R&D leur priorité. Les membres du G5 santé partagent 5 ambitions : faire reconnaître l’apport des industries des sciences de la vie en tant qu’acteur essentiel de la santé publique en France, contribuer au rétablissement de la compétitivité de la France, poursuivre un engagement fort au service de l’excellence de la recherche biomédicale française, développer l’accès des patients aux solutions de santé et soutenir le secteur des biotechnologies et des nouvelles technologies.
source : communiqué G5 santé -



 18/07/2011 [APM] - La société française
18/07/2011 [APM] - La société française 
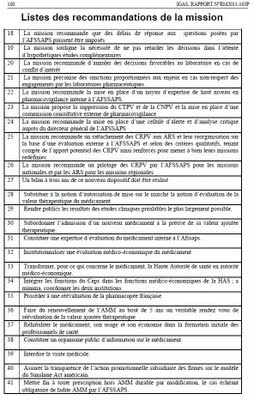
 Plan de la Synthèse du "Rapport sur la pharmacovigilance et gouvernance de la chaîne du médicament"
Plan de la Synthèse du "Rapport sur la pharmacovigilance et gouvernance de la chaîne du médicament"
 17 mars 2010 - Alors que le marché français du médicament générique a depuis 10 ans gagné en volume et en maturité et que le rôle majeur du pharmacien est unaniment reconnu et plébiscité, le
17 mars 2010 - Alors que le marché français du médicament générique a depuis 10 ans gagné en volume et en maturité et que le rôle majeur du pharmacien est unaniment reconnu et plébiscité, le 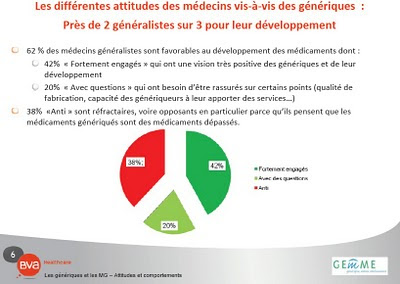
 16/02/10 - En tant que think tank et laboratoire d’idées, l’
16/02/10 - En tant que think tank et laboratoire d’idées, l’ extrait de l'article publié le
extrait de l'article publié le 


 13 juin 2008 - Bilan économique annuel des
13 juin 2008 - Bilan économique annuel des Lundi 7 Juillet 2008 -
Lundi 7 Juillet 2008 - 
