mercredi 3 février 2016
Charte de la Visite Médicale
mardi 3 janvier 2012
Publication au Journal Officiel de la LOI n° 2011-2012 du 29 décembre 2011 relative au renforcement de la sécurité sanitaire du médicament et des produits de santé
Cette réforme est l’aboutissement d’importants travaux d’évaluation, de concertations et de débats préparatoires avec tous les acteurs des produits de santé, en particulier, dans le cadre des Assises du médicament.
Cette loi, qui refonde notre système de sécurité sanitaire, repose sur trois grands axes : la prévention des conflits d’intérêt et la transparence des décisions, un doute qui doit systématiquement bénéficier au patient, ainsi qu’une meilleure formation et information des professionnels de santé et des patients.
Des exemples concrets de changement :
- L’AFSSAPS voit son expertise et ses missions renforcées et devient l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM).
- La loi oblige à la transparence de tous les liens entre les industriels et les acteurs du monde de la santé : toutes les conventions seront désormais rendues publiques. La prévention des conflits d’intérêts et la transparence des décisions sont les gages indispensables pour garantir la qualité des décisions prises.
- Le médicament sera évalué en continu tout au long de sa vie : la pharmacovigilance sur le territoire national sera renforcée, permettant de faire preuve de toute la fermeté nécessaire, lorsqu’il s’agit de retirer un médicament du marché.
- Les règles pour l’admission au remboursement seront également plus strictes : il faudra désormais disposer de comparaison avec des stratégiques thérapeutiques de référence, lorsqu’elles existent.
- Dans un souci de protection des patients, la loi prévoit également un meilleur encadrement des prescriptions hors AMM, ainsi que du dispositif des Autorisations Temporaires d’Utilisation (ATU).
- Concernant l’information sur les produits de santé, un portail internet colligeant l’ensemble des éléments de l’ANSM, la HAS et l’Assurance Maladie, sera à disposition du public et des professionnels de santé. La publicité des médicaments auprès des professionnels de santé sera désormais soumise à un contrôle a priori de l’ANSM. Quant aux dispositifs médicaux, leur publicité bénéficiera d’un encadrement analogue.
Les ministres seront particulièrement vigilants à ce que les décrets d’application de cette loi puissent paraître le plus rapidement possible.
I. – A titre expérimental et pour une période ne pouvant excéder deux ans, l’information par démarchage ou la prospection pour les produits de santé mentionnés à l’article L. 5311-1 du code de la santé publique, à l’exception des médicaments réservés à l’usage hospitalier et de ceux à prescription hospitalière initiale ou non ainsi que des produits visés à l’article L. 5211-1 du même code, effectuée dans les établissements de santé ne peut avoir lieu que devant plusieurs professionnels de santé, dans les conditions définies par convention conclue entre chaque établissement de santé et l’employeur de la personne concernée, dont les modalités sont définies par arrêté du ministre chargé de la santé pris après avis de la Haute Autorité de santé.
Avant le 1er janvier 2013, le Gouvernement présente au Parlement un rapport dressant le bilan de l’expérimentation prévue au premier alinéa, réalisé à partir d’une évaluation conduite par la Haute Autorité de santé. Ce rapport peut proposer les évolutions législatives découlant du bilan, notamment en ce qui concerne la pérennisation des dispositions en cause ainsi que leur éventuelle adaptation à la médecine de ville.
source : Communiqué de presse du Ministère de la Santé du 30 décembre 2011 -
jeudi 23 juin 2011
Interdire la visite médicale est la recommandation numéro 39 du rapport sur la pharmacovigilance et gouvernance de la chaine du médicament de l'IGAS
 Plan de la Synthèse du "Rapport sur la pharmacovigilance et gouvernance de la chaîne du médicament"
Plan de la Synthèse du "Rapport sur la pharmacovigilance et gouvernance de la chaîne du médicament"1. UNE PHARMACOVIGILANCE EN DECALAGE AVEC LES OBJECTIFS AFFICHES : UN CHANGEMENT DE METHODE ET DE CULTURE QUI S’IMPOSE
1.1. La pharmacovigilance française n’a adapté ni ses méthodes, ni ses outils au fil du temps : des réformes d’ampleur s’imposent
1.1.1. Favoriser, simplifier, centraliser la notification des cas et élargir le champ des notificateurs
1.1.2. Modifier la logique d’évaluation des cas
1.1.2.1. Effectuer les redressements utiles pour le calcul du risque
1.1.2.2. Supprimer l’usage de l’imputabilité clinique dans les enquêtes de pharmacovigilance
1.1.3. Développer les méta-analyses et la recherche documentaire
1.1.4. Consolider la base nationale de données de pharmacovigilance de l’AFSSAPS
1.1.5. Mettre en oeuvre sans tarder des méthodes automatisées de détection des signaux
1.1.6. Développer un département de pharmaco-épidémiologie au sein de l’AFSSAPS
1.1.7. Rééquilibrer les rapports entre l’AFSSAPS et les laboratoires
1.1.8. Donner la priorité au principe de précaution en mettant fin à une culture historique du juridisme, en s’affranchissant des fausses contraintes communautaires
1.1.9. Mettre fin à l’incohérence qui voit des médicaments proposés au déremboursement par la commission de transparence pour des raisons de sécurité sanitaire rester sur le marché

2.1. Un renforcement indispensable de l’expertise interne
2.2. Des commissions à restructurer, avec un nombre de membres compatible avec les débats et des rôles bien définis
2.3. Un renforcement et une réorganisation indispensables du réseau décentralisé de pharmacovigilance
2.4. La nécessité de maintenir une organisation où pharmacovigilance et
évaluation du médicament coexistent au sein de la même institution
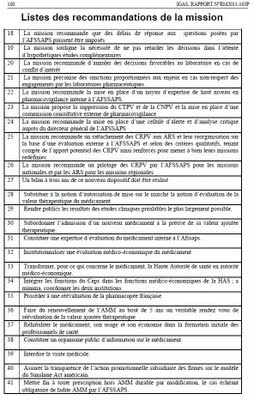
3. L’INEXISTENCE DANS NOTRE PAYS D’UNE POLITIQUE DU MEDICAMENT ET D’UNE CHAINE INSTITUTIONNELLE
3.1. L’absence de politique du médicament
3.2. L’absence de chaîne du médicament organisée
3.3. Ce constat regrettable renvoie à un double désengagement de l’Etat : face aux agences, face à l’Union européenne.
3.4. LA refonte de l’évaluation du médicament
3.4.1. La redéfinition des trois grands critères d’évaluation du médicament
3.4.1.1. L’instauration d’un critère de valeur ajoutée thérapeutique
3.4.1.2. L’institutionnalisation du critère de la valeur médico-économique du médicament
3.4.1.3. L’introduction du critère du nombre global de médicaments
3.4.2. La création d’une expertise interne pour l’évaluation du médicament
3.5. la refonte de formation et de l’information sur le médicament
3.5.1. Une formation initiale aux médicaments
3.5.2. La nécessaire indépendance du développement professionnel continu et de l’information des professionnels.
"Le constat sur ce sujet a été fait maintes fois, comparant la faiblesse des autorités publiques à l’influence des firmes pharmaceutiques.
Les pouvoirs publics se satisfont de cette situation, voire l’estiment inéluctable, se contentant de taxer les comportements plutôt que de les changer (ex : taxe sur les dépenses de promotion), de mettre en oeuvre des régulations a minima et le plus souvent formelle car non contrôlées et non sanctionnées (ex : sur la visite médicale : charte Ceps-Leem, certification par la Has).
La mission estime cette situation dépassée et de fait sans véritable comparaison à l’étranger.
Elle propose dès lors les 4 réformes suivantes.
1/ La constitution d’un organisme public d’information sur le médicament « filiale commune » de l’Afssaps, la Has, l’Assurance maladie.
Cet organisme aurait trois objectifs : professionnaliser cette fonction d’information ; coordonner celle-ci, aucun message vers les professionnels de santé ne pouvant émaner d’autre que de cet organisme ; objectiver cette fonction par une communication globale sur la valeur thérapeutique et la valeur médico-économique du médicament et son insertion dans une stratégie de santé.
Cet organisme serait aussi chargé de l’information du public sur le médicament.
De nouveau la mission constate que ce type d’organisation existe dans de nombreux pays (ex : Canada, Allemagne, Belgique, Pays-Bas, Nouvelle Zélande) et que les acteurs français ont pris beaucoup de retards.
2/ L’interdiction
La mission estime qu’il n’y pas d’alternative à l’interdiction de la visite médicale comme les tentatives de régulation menées depuis quelques années l’ont montré. Il s’agit à cet égard d’un enjeu financier majeur de 1,1 milliards d’euros.
En cohérence avec cette interdiction, la mission propose : la baisse à due concurrence des prix des médicaments ; le recyclage de cette économie pour financer le développement professionnel continu par les universités et par des réseaux professionnels désormais indépendants des firmes ; le recyclage de cette économie pour financer la politique d’information publique coordonnée et pratique vers les professionnels de santé et vers le grand public décrite précédemment ; le recyclage de cette économie dans la recherche publique et privée en faveur du médicament.
3/ La transparence de l’action promotionnelle subsidiaire des firmes.
La mission propose l’affichage de toutes les contributions des firmes pharmaceutiques aux parties prenantes de la politique de santé, quelle qu’en soit la nature, sur le modèle du Sunshine Act américain.
4/ le maintien d’une opposition absolue de notre pays dans le concert européen à toute amodiation des règles actuelles de non promotion des médicaments vers le public."
CONCLUSION
jeudi 3 mars 2011
LEEM : Les visiteurs médicaux sont des acteurs responsables de la chaîne du médicament
 08/02/2011 - Le Leem tient à exprimer son soutien à l’ensemble des professionnels de la visite médicale, aujourd’hui violemment attaqués dans leurs pratiques, dans leurs motivations, et dans leurs compétences.
08/02/2011 - Le Leem tient à exprimer son soutien à l’ensemble des professionnels de la visite médicale, aujourd’hui violemment attaqués dans leurs pratiques, dans leurs motivations, et dans leurs compétences.Cette stigmatisation ne rend pas justice aux efforts considérables que cette profession a déployés ces dernières années pour inscrire ses missions dans un cadre rénové.
Les Entreprises du Médicament rappellent que l’activité de la visite médicale s’exerce dans l’ensemble des pays industrialisés, et qu’elle répond, en France, à des règles déontologiques extrêmement strictes.
Les visiteurs médicaux sont des acteurs clé de l’information et de la pharmacovigilance.
Ce sont des professionnels formés et encadrés, et leur activité est dûment certifiée et contrôlée. Depuis 2004, une Charte de qualité signée entre l’Etat et l’industrie consacre les règles de bonnes pratiques élaborées par Les Entreprises du Médicament. Cette charte indique notamment que l’information délivrée par le délégué médical doit s’appuyer sur les avis des autorités sanitaires. A partir de cette charte, la Haute Autorité de Santé certifie la visite médicale de chaque laboratoire pour une durée de 3 ans avec un suivi annuel.
Cette profession n’a jamais été aussi contrôlée qu'aujourd'hui, tant en interne que par des organismes de certification externes.
Parallèlement, elle se trouve particulièrement exposée au changement de modèle économique qui affecte lourdement l’industrie du médicament, du fait notamment des échéances de brevet et de la montée en puissance des génériques. En cinq ans, les effectifs de la visite médicale en France ont ainsi baissé de 24 %.
Dans ce contexte, le Leem a élaboré avec les partenaires sociaux différents outils d’orientation, de mobilité professionnelle et de formation pour accompagner les entreprises du secteur dans la mise en place d’une politique de gestion prévisionnelle des emplois et des compétences (GPEC). Celle-ci doit permettre d’accompagner les visiteurs médicaux dans la transition de leur métier et de maîtriser les conséquences des changements structurels que connaît cette activité.
Le métier de la visite médicale participe au système de santé. Il doit poursuivre son adaptation aux évolutions de l’information sur le médicament, dans le respect scrupuleux de la liberté du médecin, et dans un modèle économique et social transformé.
Les visiteurs médicaux doivent pouvoir assumer leur mission, dans le respect de leur personne et de leur métier.
vendredi 11 juin 2010
Chiffres de l'investissement promotionnel des laboratoires pharmaceutiques dans le monde en 2009 publiés par Cegedim Strategic Data (CSD)
 29 mars 2010 – Cegedim Strategic Data (CSD), leader dans le domaine des études de marché dédiées à l'industrie de la santé, annonce que les dépenses promotionnelles mondiales des laboratoires pharmaceutiques en matière de visite médicale et autres canaux marketing ont augmenté de 1,6% en 2009, à taux de change constants par rapport à 2008, pour atteindre 93,2 milliards de dollars sur l’année.
29 mars 2010 – Cegedim Strategic Data (CSD), leader dans le domaine des études de marché dédiées à l'industrie de la santé, annonce que les dépenses promotionnelles mondiales des laboratoires pharmaceutiques en matière de visite médicale et autres canaux marketing ont augmenté de 1,6% en 2009, à taux de change constants par rapport à 2008, pour atteindre 93,2 milliards de dollars sur l’année.CSD analyse dans 39 pays les dépenses promotionnelles de l’industrie pharmaceutique en matière de visite médicale, échantillons, réunions professionnelles et congrès, études cliniques, DTC (Direct-to-consumer), e-promotion, annonces presse et autres canaux marketing. Ses études consistent en un suivi quotidien de l’activité promotionnelle de ce secteur et s’appuient sur des panels de 30 000 médecins généralistes, spécialistes, pharmaciens et autres professionnels de santé.
Pendant les 12 mois de l’année 2009, les budgets dédiés à la visite médicale sont restés stables, à 55,7 milliards de dollars et ont représenté un peu moins de 60% du mix-marketing.
Les dépenses consacrées aux réunions professionnelles et congrès ont progressé de façon significative soit plus de 10% sur la même période, pour atteindre un montant global de 13,4 milliards de dollars.
Les dépenses d’e-promotion ont, elles, augmenté de plus de 15%, confirmant une dynamique de croissance à deux chiffres. En revanche les annonces presse, le DTC et les études post-marketing ont vu leurs investissements diminuer sur la période étudiée...
[...]
...L’investissement marketing mondial des 10 premières entreprises a légèrement diminué en 2009, mais a représenté tout de même plus de 43% de l’investissement marketing total. Cinq des 10 premières entreprises sont basées en Europe et quatre aux Etats-Unis. Une multinationale japonaise complète ce top 10 en 2009.
Le cardiovasculaire arrive en tête des classes de médicaments les plus promus, les traitements contre l’hyperlipidémie captant presque 5% de l’effort promotionnel mondial. Le diabète et la dépression figurent également dans le top 5 des classes de médicaments bénéficiant du plus grand effort de promotion... lire tout le PDF du communiqué de presse du Groupe CEGEDIM -
mercredi 17 mars 2010
Coheris Trade v.4 : Progiciel vertical pour la gestion des forces de ventes nomades dans l'industrie de produits (para) pharmaceutiques...
 17/03/2010 - Coheris présente les nouveautés de sa suite Coheris Trade v.4 -
17/03/2010 - Coheris présente les nouveautés de sa suite Coheris Trade v.4 -Coheris, éditeur de référence sur le marché français du CRM, présente à l'occasion du Stratégie Clients 2010 (stand E13), la nouvelle version majeure de sa solution SFA : Coheris Trade v.4.
Progiciel vertical pour la gestion des forces de ventes nomades dans les industries des biens de consommation et de produits (para) pharmaceutiques, Coheris Trade V4 est une version qui intègre de nouvelles fonctions métier très importantes
* Gestion des promotions et prévisions de ventes : optimisation des processus de gestion des promotions et de prévision des ventes associées, pour les industriels fournisseurs de la grande distribution. Un plan promo national est construit graphiquement, en tenant compte des différents "temps forts" commerciaux. Ce plan promo national et les prévisions de ventes sont ensuite déclinés par marque et par enseigne de distribution.
* Gestion du réseau des visiteurs médicaux : fonctions de gestion et de support aux visiteurs médicaux des laboratoires pharmaceutiques, en complément de la gestion du réseau des délégués pharmaceutiques. Coheris Trade V4 permet aux laboratoires de gérer leurs deux réseaux commerciaux et mettre en évidence des synergies par zone géographique (relation entre prescriptions et ventes).
lire le communiqué de presse Coheris -
mercredi 16 décembre 2009
Certification de la charte de la visite médicale : premier bilan de la Haute Autorité de Santé
 1 décembre 2009 - Certification de la charte de la visite médicale, la HAS publie un premier bilan -
1 décembre 2009 - Certification de la charte de la visite médicale, la HAS publie un premier bilan -La HAS publie le premier bilan de cette mission, qui met en évidence les limites de la certification et les difficultés d’en mesurer précisément l’impact. Elle propose quatre orientations, certaines nécessitant des évolutions de la charte elle-même ou de la réglementation.
La loi du 13 août 2004 (loi n° 2004-810 du 13 août 2004 relative à l'assurance maladie) a confié à la HAS une mission de traduction de la charte de la visite médicale signée entre le LEEM et le CEPS en une procédure de certification. Le premier référentiel de certification a été publié en juillet 2006, les premiers certificats ayant été délivrés en janvier 2007.
Depuis cette version plusieurs évolutions sont intervenues : interprétation rigoureuse de l’interdiction de remise de cadeaux, même de valeur négligeable, élargissement de la procédure aux prestataires de visite médicale, sous la responsabilité des laboratoires donneurs d’ordre, ainsi qu’à l’hôpital à la suite de la signature d’un avenant par le LEEM et le CEPS à l’été 2008... lire l'intégralité du communiqué de presse de la Haute Autorité de Santé [HAS] -
jeudi 17 avril 2008
Cegedim : Impact limité de la visite médicale sur les dépenses de santé
 Selon une étude de Cegedim, l'impact des visiteurs médicaux sur les dépenses de santé est limité.
Selon une étude de Cegedim, l'impact des visiteurs médicaux sur les dépenses de santé est limité.Les laboratoires pharmaceutiques, qui dépensent 3 milliards d'euros par an pour promouvoir leurs produits auprès de 25 000 médecins, subissent régulièrement les foudres des corps de contrôle de l'Etat et de la Sécurité sociale pour ces visites médicales.
Une étude menée par Cegedim, leader mondial des bases de données médicales, auprès d'un panel de 1 000 médecins, a tenté d'analyser la pression exercée par les laboratoires sur la prescription médicale. L'étude révèle que cette pression tend à se réduire : entre 2005 et 2007, le nombre de visites médicales a chuté de 10 %... lire l'article du Monde du 12 avril 2008 -
lundi 17 mars 2008
HAS : désormais la procédure de certification de la visite médicale concerne aussi les prestataires
 15 février 2008 - La Haute Autorité de Santé [HAS] publie une nouvelle version du référentiel de certification de la visite médicale. La procédure de certification est élargie aux prestataires de visite médicale.
15 février 2008 - La Haute Autorité de Santé [HAS] publie une nouvelle version du référentiel de certification de la visite médicale. La procédure de certification est élargie aux prestataires de visite médicale.La certification de la visite médicale s’applique désormais aux prestataires de visite médicale. Toute entreprise prestataire de visite médicale devra être certifiée pour ses activités de visite médicale en ville, et devra s’engager contractuellement avec un organisme certificateur avant le 31 décembre 2008... lire le communiqué de presse de l'HAS -
jeudi 28 février 2008
Charte de la visite médicale
 Pour en savoir plus sur l'organisation du métier de visiteur ou délégué médical, voici le lien vers le résumé vidéo d'une des soirées-débats de l'Association des cadres de l'Industrie Pharmaceutique (ACIP) .
Pour en savoir plus sur l'organisation du métier de visiteur ou délégué médical, voici le lien vers le résumé vidéo d'une des soirées-débats de l'Association des cadres de l'Industrie Pharmaceutique (ACIP) .Cette Association, créée en 1956, s'adresse aux cadres de toutes spécialités et de toutes origines de l'Industrie Pharmaceutique, donc de tous niveaux hiérarchiques, allant des PDG aux cadres débutants.
L'intérêt de l'ACIP est reconnu par de nombreuses personnalités du monde de la Santé (Universitaires de haut niveau, Personnalités politiques, Hauts responsables de l'Administration) qui participent régulièrement aux débats qui sont organisés :
cliquer sur ce lien pour voir la vidéo sur la charte de la visite médicale -
mercredi 16 janvier 2008
Réponses du LEEM à l'UFC
 Suite aux prises de position de l'UFC-Que Choisir (dossier Prescriptions de médicaments du 15/01/08), le LEEM (les entreprises du médicament) a réagi. Voici quelques extraits :
Suite aux prises de position de l'UFC-Que Choisir (dossier Prescriptions de médicaments du 15/01/08), le LEEM (les entreprises du médicament) a réagi. Voici quelques extraits :« L'UFC n'apporte aucune référence chiffrée sur la visite médicale, et aucune donnée clairement et rigoureusement référencée sur la question de la rationalisation des prescriptions de médicaments ». (AFP, 15/01/08 – 18h30)
« Il n’y a pas de pression effrénée de la part des visiteurs médicaux. Nous sommes dans une démarche d’amélioration de la qualité de la pratique » reconnue par toutes les certifications accordées aux entreprises en 2007. (TF1, Journal de 20h –15/01/08)
« Je ne vois pas au nom de quoi l’UFC-Que Choisir est habilitée à faire de telles propositions. La visite médicale est, dans notre pays, strictement encadrée, en accord avec le gouvernement et les entreprises du médicament ». (Le Quotidien du Pharmacien, à paraître)
« Pour revenir aux visiteurs médicaux, ils ne sont pas des piliers avec une pancarte promotionnelle indiquant «prescrivez mon médicament». Ils font de la promotion, mais aussi de l'information, de la sensibilisation aux progrès, et sont la principale source de remontées de pharmacovigilance ». (Le Quotidien du Pharmacien, à paraître)
Lire toutes les réponses du Leem.

