 Plan de la Synthèse du "Rapport sur la pharmacovigilance et gouvernance de la chaîne du médicament"
Plan de la Synthèse du "Rapport sur la pharmacovigilance et gouvernance de la chaîne du médicament"1. UNE PHARMACOVIGILANCE EN DECALAGE AVEC LES OBJECTIFS AFFICHES : UN CHANGEMENT DE METHODE ET DE CULTURE QUI S’IMPOSE
1.1. La pharmacovigilance française n’a adapté ni ses méthodes, ni ses outils au fil du temps : des réformes d’ampleur s’imposent
1.1.1. Favoriser, simplifier, centraliser la notification des cas et élargir le champ des notificateurs
1.1.2. Modifier la logique d’évaluation des cas
1.1.2.1. Effectuer les redressements utiles pour le calcul du risque
1.1.2.2. Supprimer l’usage de l’imputabilité clinique dans les enquêtes de pharmacovigilance
1.1.3. Développer les méta-analyses et la recherche documentaire
1.1.4. Consolider la base nationale de données de pharmacovigilance de l’AFSSAPS
1.1.5. Mettre en oeuvre sans tarder des méthodes automatisées de détection des signaux
1.1.6. Développer un département de pharmaco-épidémiologie au sein de l’AFSSAPS
1.1.7. Rééquilibrer les rapports entre l’AFSSAPS et les laboratoires
1.1.8. Donner la priorité au principe de précaution en mettant fin à une culture historique du juridisme, en s’affranchissant des fausses contraintes communautaires
1.1.9. Mettre fin à l’incohérence qui voit des médicaments proposés au déremboursement par la commission de transparence pour des raisons de sécurité sanitaire rester sur le marché

cliquer sur l'image pour l'agrandir
2. UNE ORGANISATION TROP CLOISONNEE ET INADAPTEE AU SEIN DE L’AFSSAPS ET AU NIVEAU REGIONAL
2.1. Un renforcement indispensable de l’expertise interne
2.2. Des commissions à restructurer, avec un nombre de membres compatible avec les débats et des rôles bien définis
2.3. Un renforcement et une réorganisation indispensables du réseau décentralisé de pharmacovigilance
2.4. La nécessité de maintenir une organisation où pharmacovigilance et
évaluation du médicament coexistent au sein de la même institution
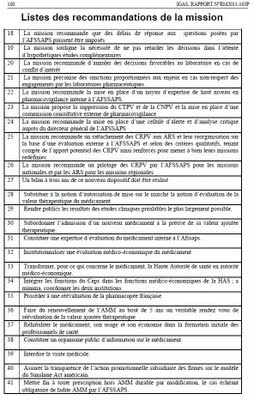
3. L’INEXISTENCE DANS NOTRE PAYS D’UNE POLITIQUE DU MEDICAMENT ET D’UNE CHAINE INSTITUTIONNELLE
3.1. L’absence de politique du médicament
3.2. L’absence de chaîne du médicament organisée
3.3. Ce constat regrettable renvoie à un double désengagement de l’Etat : face aux agences, face à l’Union européenne.
3.4. LA refonte de l’évaluation du médicament
3.4.1. La redéfinition des trois grands critères d’évaluation du médicament
3.4.1.1. L’instauration d’un critère de valeur ajoutée thérapeutique
3.4.1.2. L’institutionnalisation du critère de la valeur médico-économique du médicament
3.4.1.3. L’introduction du critère du nombre global de médicaments
3.4.2. La création d’une expertise interne pour l’évaluation du médicament
3.5. la refonte de formation et de l’information sur le médicament
3.5.1. Une formation initiale aux médicaments
3.5.2. La nécessaire indépendance du développement professionnel continu et de l’information des professionnels.
"Le constat sur ce sujet a été fait maintes fois, comparant la faiblesse des autorités publiques à l’influence des firmes pharmaceutiques.
Les pouvoirs publics se satisfont de cette situation, voire l’estiment inéluctable, se contentant de taxer les comportements plutôt que de les changer (ex : taxe sur les dépenses de promotion), de mettre en oeuvre des régulations a minima et le plus souvent formelle car non contrôlées et non sanctionnées (ex : sur la visite médicale : charte Ceps-Leem, certification par la Has).
La mission estime cette situation dépassée et de fait sans véritable comparaison à l’étranger.
Elle propose dès lors les 4 réformes suivantes.
1/ La constitution d’un organisme public d’information sur le médicament « filiale commune » de l’Afssaps, la Has, l’Assurance maladie.
Cet organisme aurait trois objectifs : professionnaliser cette fonction d’information ; coordonner celle-ci, aucun message vers les professionnels de santé ne pouvant émaner d’autre que de cet organisme ; objectiver cette fonction par une communication globale sur la valeur thérapeutique et la valeur médico-économique du médicament et son insertion dans une stratégie de santé.
Cet organisme serait aussi chargé de l’information du public sur le médicament.
De nouveau la mission constate que ce type d’organisation existe dans de nombreux pays (ex : Canada, Allemagne, Belgique, Pays-Bas, Nouvelle Zélande) et que les acteurs français ont pris beaucoup de retards.
2/ L’interdiction
La mission estime qu’il n’y pas d’alternative à l’interdiction de la visite médicale comme les tentatives de régulation menées depuis quelques années l’ont montré. Il s’agit à cet égard d’un enjeu financier majeur de 1,1 milliards d’euros.
En cohérence avec cette interdiction, la mission propose : la baisse à due concurrence des prix des médicaments ; le recyclage de cette économie pour financer le développement professionnel continu par les universités et par des réseaux professionnels désormais indépendants des firmes ; le recyclage de cette économie pour financer la politique d’information publique coordonnée et pratique vers les professionnels de santé et vers le grand public décrite précédemment ; le recyclage de cette économie dans la recherche publique et privée en faveur du médicament.
3/ La transparence de l’action promotionnelle subsidiaire des firmes.
La mission propose l’affichage de toutes les contributions des firmes pharmaceutiques aux parties prenantes de la politique de santé, quelle qu’en soit la nature, sur le modèle du Sunshine Act américain.
4/ le maintien d’une opposition absolue de notre pays dans le concert européen à toute amodiation des règles actuelles de non promotion des médicaments vers le public."
CONCLUSION
2.1. Un renforcement indispensable de l’expertise interne
2.2. Des commissions à restructurer, avec un nombre de membres compatible avec les débats et des rôles bien définis
2.3. Un renforcement et une réorganisation indispensables du réseau décentralisé de pharmacovigilance
2.4. La nécessité de maintenir une organisation où pharmacovigilance et
évaluation du médicament coexistent au sein de la même institution

cliquer sur l'image pour l'agrandir
3. L’INEXISTENCE DANS NOTRE PAYS D’UNE POLITIQUE DU MEDICAMENT ET D’UNE CHAINE INSTITUTIONNELLE
3.1. L’absence de politique du médicament
3.2. L’absence de chaîne du médicament organisée
3.3. Ce constat regrettable renvoie à un double désengagement de l’Etat : face aux agences, face à l’Union européenne.
3.4. LA refonte de l’évaluation du médicament
3.4.1. La redéfinition des trois grands critères d’évaluation du médicament
3.4.1.1. L’instauration d’un critère de valeur ajoutée thérapeutique
3.4.1.2. L’institutionnalisation du critère de la valeur médico-économique du médicament
3.4.1.3. L’introduction du critère du nombre global de médicaments
3.4.2. La création d’une expertise interne pour l’évaluation du médicament
3.5. la refonte de formation et de l’information sur le médicament
3.5.1. Une formation initiale aux médicaments
3.5.2. La nécessaire indépendance du développement professionnel continu et de l’information des professionnels.
"Le constat sur ce sujet a été fait maintes fois, comparant la faiblesse des autorités publiques à l’influence des firmes pharmaceutiques.
Les pouvoirs publics se satisfont de cette situation, voire l’estiment inéluctable, se contentant de taxer les comportements plutôt que de les changer (ex : taxe sur les dépenses de promotion), de mettre en oeuvre des régulations a minima et le plus souvent formelle car non contrôlées et non sanctionnées (ex : sur la visite médicale : charte Ceps-Leem, certification par la Has).
La mission estime cette situation dépassée et de fait sans véritable comparaison à l’étranger.
Elle propose dès lors les 4 réformes suivantes.
1/ La constitution d’un organisme public d’information sur le médicament « filiale commune » de l’Afssaps, la Has, l’Assurance maladie.
Cet organisme aurait trois objectifs : professionnaliser cette fonction d’information ; coordonner celle-ci, aucun message vers les professionnels de santé ne pouvant émaner d’autre que de cet organisme ; objectiver cette fonction par une communication globale sur la valeur thérapeutique et la valeur médico-économique du médicament et son insertion dans une stratégie de santé.
Cet organisme serait aussi chargé de l’information du public sur le médicament.
De nouveau la mission constate que ce type d’organisation existe dans de nombreux pays (ex : Canada, Allemagne, Belgique, Pays-Bas, Nouvelle Zélande) et que les acteurs français ont pris beaucoup de retards.
2/ L’interdiction
La mission estime qu’il n’y pas d’alternative à l’interdiction de la visite médicale comme les tentatives de régulation menées depuis quelques années l’ont montré. Il s’agit à cet égard d’un enjeu financier majeur de 1,1 milliards d’euros.
En cohérence avec cette interdiction, la mission propose : la baisse à due concurrence des prix des médicaments ; le recyclage de cette économie pour financer le développement professionnel continu par les universités et par des réseaux professionnels désormais indépendants des firmes ; le recyclage de cette économie pour financer la politique d’information publique coordonnée et pratique vers les professionnels de santé et vers le grand public décrite précédemment ; le recyclage de cette économie dans la recherche publique et privée en faveur du médicament.
3/ La transparence de l’action promotionnelle subsidiaire des firmes.
La mission propose l’affichage de toutes les contributions des firmes pharmaceutiques aux parties prenantes de la politique de santé, quelle qu’en soit la nature, sur le modèle du Sunshine Act américain.
4/ le maintien d’une opposition absolue de notre pays dans le concert européen à toute amodiation des règles actuelles de non promotion des médicaments vers le public."
CONCLUSION
